HỌC VIỆN HOÀNG GIA
15 câu Trắc nghiệm Hóa học 10 Chân trời sáng tạo Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học có đáp án
Đề thi đã ghi nhận 2850 lượt thi, với 15 câu hỏi được thiết kế nhằm đánh giá toàn diện kiến thức môn Hóa học Lớp 10 của học sinh. Thời gian làm bài là 30 phút. Đề thi nhận được hơn 480 lượt đánh giá tích cực từ những học sinh đã tham gia làm bài
LÀM BÀI THI
Cho các phát biểu sau
(1) Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường.
(2) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
(3) Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
(4) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường.
Các phát biểu đúng là
Đáp án đúng là: A
Các phát biểu đúng là
(1) Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường.
(2) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
Phản ứng nào trong các phản ứng dưới đây là phản ứng thu nhiệt?
Đáp án đúng là: D
Vôi sống tác dụng với nước: CaO + H2O ⟶ Ca(OH)2 phản ứng xảy ra ở điều kiện thường và làm nhiệt độ môi trường xung quanh nóng lên ⇒ Phản ứng tỏa nhiệt.
Đốt cháy than: C + O2 CO2 và đốt cháy cồn: C2H5OH + 3O2
CO2 và đốt cháy cồn: C2H5OH + 3O2 2CO2 + 3H2O cần cung cấp nhiệt độ ban đầu sau đó phản ứng tự cháy và tỏa nhiệt. ⇒ Phản ứng tỏa nhiệt.
2CO2 + 3H2O cần cung cấp nhiệt độ ban đầu sau đó phản ứng tự cháy và tỏa nhiệt. ⇒ Phản ứng tỏa nhiệt.
Nung đá vôi: CaCO3 CaO + CO2 phản ứng cần cung cấp nhiệt độ trong toàn bộ quá trình, nếu ngừng cung cấp nhiệt phản ứng không xảy ra. ⇒ Phản ứng thu nhiệt.
CaO + CO2 phản ứng cần cung cấp nhiệt độ trong toàn bộ quá trình, nếu ngừng cung cấp nhiệt phản ứng không xảy ra. ⇒ Phản ứng thu nhiệt.
Điều kiện chuẩn là điều kiện ứng với
Đáp án đúng là: D
Điều kiện chuẩn là điều kiện ứng với 1 bar (đối với chất khí); nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25° C (298 K).
Nhiệt kèm theo phản ứng trong điều kiện chuẩn là
Đáp án đúng là: B
Nhiệt kèm theo phản ứng trong điều kiện chuẩn là biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là  .
.
Phương trình nhiệt hóa học là
Đáp án đúng là: C
Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu và sản phẩm.
Cho 2 phương trình nhiệt hóa học sau:
C (s) + H2O (g)  CO (g) + H2 (g)
CO (g) + H2 (g)  = + 131,25 kJ (1)
= + 131,25 kJ (1)
CuSO4 (aq) + Zn (s)  ZnSO4 (aq) + Cu (s)
ZnSO4 (aq) + Cu (s)  = −231,04 kJ (2)
= −231,04 kJ (2)
Khẳng định đúng là
Đáp án đúng là: B
Phản ứng (1) có  = + 131,25 kJ > 0 nên đây là phản ứng thu nhiệt.
= + 131,25 kJ > 0 nên đây là phản ứng thu nhiệt.
Phản ứng (2) có  = −231,04 kJ < 0 nên đây là phản ứng tỏa nhiệt.
= −231,04 kJ < 0 nên đây là phản ứng tỏa nhiệt.
Enthalpy tạo thành của một chất (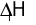 ) là nhiệt kèm theo phản ứng tạo thành
) là nhiệt kèm theo phản ứng tạo thành
Đáp án đúng là: C
Enthalpy tạo thành của một chất (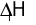 ) là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
) là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
Cho phản ứng sau:
S (s) + O2 (g)  SO2 (g)
SO2 (g)  (SO2, g) = – 296,8 kJ/mol
(SO2, g) = – 296,8 kJ/mol
Khẳng định sai là
Đáp án đúng là: D
 (SO2, g) = – 296,8 kJ/mol < 0 nên hợp chất SO2</>
(SO2, g) = – 296,8 kJ/mol < 0 nên hợp chất SO2</>
(g) bền hơn về mặt năng lượng so với các đơn chất bền S (s) và O2 (g).
Do đó khẳng định D sai.
Cho  (Fe2O3, s) = − 825,5 kJ/mol. Biết 1 J = 0,239 cal. Enthalpy tạo thành chuẩn theo đơn vị (kcal) của Fe2O3 (s) là
(Fe2O3, s) = − 825,5 kJ/mol. Biết 1 J = 0,239 cal. Enthalpy tạo thành chuẩn theo đơn vị (kcal) của Fe2O3 (s) là
Đáp án đúng là: B
1 J = 0,239 cal nên 1 kJ = 0,239 kcal
 (Fe2O3, s) = − 825,5.0,239 = − 197,2945 (kJ/mol).
(Fe2O3, s) = − 825,5.0,239 = − 197,2945 (kJ/mol).
Cho phản ứng: Na (s) +  Cl2 (g) ⟶NaCl (s) có
Cl2 (g) ⟶NaCl (s) có  (NaCl, s) = − 411,1 kJ/mol.
(NaCl, s) = − 411,1 kJ/mol.
Nếu chỉ thu được 0,5 mol NaCl (s) ở điều kiện chuẩn thì lượng nhiệt tỏa ra là
Đáp án đúng là: D
Enthalpy tạo thành chuẩn của một chất ( ) là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
) là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
Na (s) +  Cl2 (g) ⟶ NaCl (s) có
Cl2 (g) ⟶ NaCl (s) có  (NaCl, s) = − 411,1 kJ/mol
(NaCl, s) = − 411,1 kJ/mol
Nếu tạo thành 1 mol NaCl (s) thì lượng nhiệt tỏa ra là 411,1 kJ
Vậy nếu tạo thành 0,5 mol NaCl (s) thì lượng nhiệt tỏa ra là 411,1.0,5 = 205,55 (kJ)
Cho phản ứng: N2 (g) + 3H2 (g) ⟶ 2NH3 (g)
Ở điều kiện chuẩn, cứ 1 mol N2 phản ứng hết sẽ tỏa ra 91,8 kJ. Enthalpy tạo thành chuẩn của NH3 là
Đáp án đúng là: C
N2 (g) + 3H2 (g) ⟶ 2NH3 (g)
Ta có, cứ 1 mol N2 phản ứng hết sẽ tỏa ra 91,8 kJ và tạo thành 2 mol NH3
⇒ cứ 0,5 mol N2 phản ứng hết sẽ tỏa ra 91,8.0,5 = 45,9 (kJ) và tạo thành 1 mol NH3
Mà đây là phản ứng tỏa nhiệt nên  < 0.
< 0.
Vậy enthalpy tạo thành chuẩn của NH3 là  = − 45,9 kJ/mol.
= − 45,9 kJ/mol.
</>
Cho biết phản ứng tạo thành 2 mol HCl (g) ở điều kiện chuẩn tỏa ra 184,62 kJ:
H2 (g) + Cl2 (g)⟶ 2HCl (g) (*)
Những phát biểu nào dưới đây đúng?
(1) Enthalpy tạo thành chuẩn của HCl (g) là − 184,62 kJ/mol.
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ.
(3) Enthalpy tạo thành chuẩn của HCl (g) là – 92,31 kJ/mol.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ.
Đáp án đúng là: B
(1) Enthalpy tạo thành chuẩn của HCl (g) là − 184,62 kJ/mol. ⇒ sai vì − 184,62 kJ/mol là nhiệt tạo thành của 2 mol HCl (g).
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ.⇒ đúng vì biến thiên enthalpy chuẩn của phản ứng là lượng nhiệt kèm theo của phản ứng đó trong điều kiện chuẩn mà phản ứng tỏa nhiệt nên  < 0.
< 0.
(3) Enthalpy tạo thành chuẩn của HCl (g) là – 92,31 kJ/mol.⇒ đúng.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ.⇒ sai vì phản ứng tỏa nhiệt nên  < 0.
< 0.
Cho các phản ứng dưới đây:
(1) CO (g) +  O2 (g) ⟶ CO2 (g)
O2 (g) ⟶ CO2 (g)  = − 283 kJ
= − 283 kJ
(2) C (s) + H2O (g)  CO (g) + H2 (g)
CO (g) + H2 (g)  = + 131,25 kJ
= + 131,25 kJ
(3) H2 (g) + F2 (g) ⟶ 2HF (g)  = − 546 kJ
= − 546 kJ
(4) H2 (g) + Cl2 (g)⟶ 2HCl (g)  = − 184,62 kJ
= − 184,62 kJ
Phản ứng xảy ra thuận lợi nhất là
Đáp án đúng là: C
Phản ứng có  < 0 thường xảy ra thuận lợi hơn.
< 0 thường xảy ra thuận lợi hơn.
Mà phản ứng (3) có  nhỏ nhất nên xảy ra thuận lợi nhất.
nhỏ nhất nên xảy ra thuận lợi nhất.
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2 (g) + O2 (g) ⟶ 2NO (g)  = +180 kJ
= +180 kJ
Kết luận nào sau đây đúng?
Đáp án đúng là: D
N2 (g) + O2 (g) ⟶ 2NO (g)  = +180 kJ
= +180 kJ
Ta có:  = +180 kJ > 0 nên đây là phản ứng thu nhiệt xảy ra ở nhiệt độ cao. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
= +180 kJ > 0 nên đây là phản ứng thu nhiệt xảy ra ở nhiệt độ cao. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng?
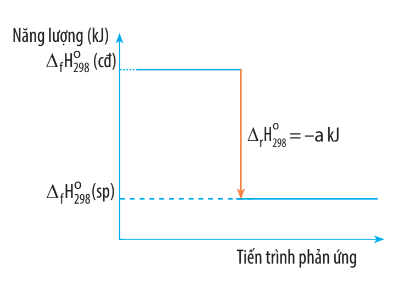
Đáp án đúng là: A
Từ sơ đồ ta thấy:  (sp) <
(sp) <  (cđ) nên
(cđ) nên  < 0 và
< 0 và  = − a kJ.</></>
= − a kJ.</></>
Do đó đây là phản ứng tỏa nhiệt.
Vậy kết luận A đúng.
ĐỀ THI KHÁC TRONG BỘ ĐỀ THI
BỘ ĐỀ THI LIÊN QUAN
DANH SÁCH CÂU HỎI
Cho các phát biểu sau
(1) Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường.
(2) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
(3) Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
(4) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường.
Các phát biểu đúng là
Cho 2 phương trình nhiệt hóa học sau:
C (s) + H2O (g)  CO (g) + H2 (g)
CO (g) + H2 (g)  = + 131,25 kJ (1)
= + 131,25 kJ (1)
CuSO4 (aq) + Zn (s)  ZnSO4 (aq) + Cu (s)
ZnSO4 (aq) + Cu (s)  = −231,04 kJ (2)
= −231,04 kJ (2)
Khẳng định đúng là
Cho  (Fe2O3, s) = − 825,5 kJ/mol. Biết 1 J = 0,239 cal. Enthalpy tạo thành chuẩn theo đơn vị (kcal) của Fe2O3 (s) là
(Fe2O3, s) = − 825,5 kJ/mol. Biết 1 J = 0,239 cal. Enthalpy tạo thành chuẩn theo đơn vị (kcal) của Fe2O3 (s) là
Cho phản ứng: Na (s) +  Cl2 (g) ⟶NaCl (s) có
Cl2 (g) ⟶NaCl (s) có  (NaCl, s) = − 411,1 kJ/mol.
(NaCl, s) = − 411,1 kJ/mol.
Nếu chỉ thu được 0,5 mol NaCl (s) ở điều kiện chuẩn thì lượng nhiệt tỏa ra là
Cho phản ứng: N2 (g) + 3H2 (g) ⟶ 2NH3 (g)
Ở điều kiện chuẩn, cứ 1 mol N2 phản ứng hết sẽ tỏa ra 91,8 kJ. Enthalpy tạo thành chuẩn của NH3 là
Cho biết phản ứng tạo thành 2 mol HCl (g) ở điều kiện chuẩn tỏa ra 184,62 kJ:
H2 (g) + Cl2 (g)⟶ 2HCl (g) (*)
Những phát biểu nào dưới đây đúng?
(1) Enthalpy tạo thành chuẩn của HCl (g) là − 184,62 kJ/mol.
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ.
(3) Enthalpy tạo thành chuẩn của HCl (g) là – 92,31 kJ/mol.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ.
Cho các phản ứng dưới đây:
(1) CO (g) +  O2 (g) ⟶ CO2 (g)
O2 (g) ⟶ CO2 (g)  = − 283 kJ
= − 283 kJ
(2) C (s) + H2O (g)  CO (g) + H2 (g)
CO (g) + H2 (g)  = + 131,25 kJ
= + 131,25 kJ
(3) H2 (g) + F2 (g) ⟶ 2HF (g)  = − 546 kJ
= − 546 kJ
(4) H2 (g) + Cl2 (g)⟶ 2HCl (g)  = − 184,62 kJ
= − 184,62 kJ
Phản ứng xảy ra thuận lợi nhất là